
 |
|
|
Главная Переработка нефти и газа характеризует изменение единицы объема воды при изменении давления на единицу. В формуле (V.14) ДУ - изменение объема воды при изменении давления на Др, а V - объем воды при условиях опыта. Коэффициент сжимаемости воды изменяется в пластовых условиях в пределах (3,7-5,0) 10""" мН, а при наличии растворенного газа увеличивается и может быть нриближенно определен по формуле Рвг = Рв (1+0,055), (V.15) где Рвг - коэффициент сжимаемости воды, содержащий растворенный газ, в mVH; Рв - коэффициент сжимаемости чистой воды в м7Н; S - количество газа, растворенного в воде, в м/м. Объемный коэффициент пластовой воды характеризует отношение удельного объема воды в пластовых условиях Упл к удельному объему ее в стандартных условиях У„: 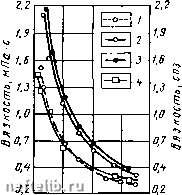 0 во 120 160 Температура, °С (V.16) Рис. V.9. Зависимость вязкоств хлоркальциевой воды Туймазинского месторождения (скв. 406), морской воды и чистой воды от температуры для ряда постоянных давлений (но В. И. Сергеевич и Т. П. Жузе). 1 - вода Каспийского моря при 29,4 МПа; 2 - вода хлоркальциевого типа при 19,6 МПа; 3 - вода хлор-кальциевого типа при 29,4 МПа; 4 - чистая вода при 29,4 МПа. Увеличение пластового давления способствует уменьшению объемного коэффициента, а рост температуры сопровождается его повышением. Поэтому объемный коэффициент воды изменяется в сравнительно узких пределах (0,99-1,06). Правый предел относится к высокой температуре (121° С) и низкому давлению, левый - к низкой температуре (38° С) и высокому давлению (32 МПа). Вязкость воды в пластовых условиях зависит в основном от температуры и концентрации растворенных солей. Как следует из рис. V.9, температура имеет большое влияние на вязкость воды. Влияние давления на вязкость воды незначительно и зависит от природы и концентрации растворенных солей и от температуры. В области низких температур (5-10° С) вязкость слабо минерализованных вод уменьшается с повышением давления. Наиболее вязки хлор-кальциевые воды. При одних и тех же условиях вязкость их превышает вязкость чистой воды в 1,5-2 раза. Так как в воде газы растворяются в небольшом количестве, вязкость ее незначительно уменьшается при насыщении газом. Поэтому вязкость воды в пластовых условиях можно определять (при практических расчетах) обычными капиллярными вискозиметрами при пластовой температуре и атмосферном давлении. § 6. РАСТВОРИМОСТЬ ГАЗОВ В ВОДЕ ПОД ДАВЛЕНИЕМ Как уже упоминалось, растворимость углеводородных газов в воде незначительна. Однако следует учитывать, что площадь контакта газовой залежи с подстилающей водой может быть большой, а давление в пласте достигать 50-70 МПа. В этих условиях значительные количества газа в воде могут находиться в растворенном состоянии. Процессы растворения и фазовые переходы углеводородов в водных системах, по-видимому, играли важную роль при миграции углеводородов и формировании газовых залежей. Поэтому вопросы растворимости углеводородов в воде привлекают возрастающее внимание исследователей [31]. Содержание растворенного газа в воде можно выразить в виде мольных долей т= \ (V.17) или же в виде объема газового компонента, растворенного в единице массы, или объема воды fc, = --; С, = -, (V.18) где ге,- и - соответственно число молей (грамм-молекул) t-ro компонента в водном растворе и числом молей воды; Vi - объемы газового компонента, приведенного к нормальным условиям (0° С и 760 мм рт. ст.); G - масса воды в (г), в которой растворен компонент. Величины Ni и fc,- связаны соотношением 1- - (V.19) 18,016 где 22 416 - объем моля идеального газа при нормальных условиях; 18,016 - молекулярная масса воды. Величина Для большинства газов (за исключением углекислого газа и сероводорода) значительно меньше, чем 1244, и поэтому можно принять Nl=j0,80A-l0-%. (V.20) Для выражения растворимости газа в воде используется также константа равновесия где N"i к Ni - мольные доли компонента в газовой и жидкой фазах. 202 Законы растворимости газов в воде отличаются некоторыми особенностями. Растворимость углеводородных (неполярных) газов в воде но. сравнению с их растворимостью в органических жидкостях весьма мала (рис. V.10). С увеличением температуры растворимость газов вначале уменьшается, а затем возрастает, пройдя через минимум. Причем, температура минимальной растворимости различных газов возрастает с увеличением размера молекулы газа [31]. Температура минимальной растворимости газов зависит от давления (рис. V.11). 3.50 1.0 0.5 5,0 10.0 15.0 20,0 25.0 Давление, МПа Рис. V.10. Кривые растворимости саратовского газа в чистой и соленой воде при различных температурах и давлениях (по данным ВНИИ). 1, 2 - дистиллированная вода; 3, 4 - 2М раствор NaCl 5 2,50 1.50 1.00
о 50 too 150 200 Температура, °С Рис. V.11. Изменение температуры минимальной растворимости этана в зависимости от давления. С повышением минерализации ухудшается растворимость газов в воде. По данным ВНИИ растворимость азота в дистиллированной воде, например, нри р = 150 кгс/см* (14,7 МПа) ж t - 25° С составляет около 1,52 м*/м*, а в четырехмолярном растворе лишь около 0,48 м7м*, т. е. более чем в 3 раза меньше. Растворимость различных газов в воде определяется по соотношению (V.21). Константы равновесия компонентов природного газа приведены в работе [31]. Они не зависят от состава и являются функцией только температуры и давления. (В обнцем случае константы равновесия компонентов и в водных системах также зависят от состава газа. Однако естественный газ состоит в основном из метана и влиянием других составляюнцих на перераспределение компонентов пренебрегают.) В табл. 4, 5 и 6 (см. приложения) приведены некоторые значения констант равновесия для метана, зтана и пропана. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 [ 64 ] 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |